抑郁症是一种严重限制心理社会功能并可能致命的疾病,是全球致残的主要原因。根据世界卫生组织(WHO)的报告,当前抑郁症已成为全球第二大致残性疾病,预计到2030年该病将成为危害人类健康的主要疾病[1]。伴随着对抑郁症的研究,现在已在其病理生理学的理解中取得了长足的进步。当前对于其发病机制已提出了几种假说,如:单胺假说、神经可塑与神经发生假说、神经内分泌假说、抑郁炎症假说等[2-6]。同时,基于以上假说探究出的相关机制,当前已经研制出了部分用于治疗抑郁症的相关药物,如:SSRIs、SNRIs等。但临床治疗中显示,患者使用SSRIs类抗抑郁药物治疗中仅有30%的患者起到了治疗效果,同时患者服用后会出现明显的毒副作用[7]。
当前的研究显示运动训练对于抑郁症的治疗效果与药物治疗相媲美,经运动训练后,抑郁症患者的抑郁症状得到了显著的改善[8]。更重要的是,运动治疗不仅具有良好的治疗效果的同时,还较其他方法(药物治疗差生的毒副作用)具备更安全、健康、花费更低的特点[9]。高强度间歇训练(high-intensity interval training,HIIT)作为近些年运动训练中的热门方式,由于其较常规的有氧训练具有较短的训练时间而获得相同或更大的运动收益等特点收到了人们的关注。其在改善抑郁症状与降低抑郁风险同样展现出巨大的潜力,同时在该过程中可能涉及到多种生物学机制。
2024年1月9日,河南大学生命科学学院魏建设教授团队和武汉体育学院王松教授团队在《国际临床与健康心理学杂志》(International Journal of Clinical and Health Psychology,IJCHP)发表了题为“Clinical value and mechanistic analysis of HIIT on modulating risk andsymptoms of depression: A systematic review”的系统综述论文,本文总结了HIIT对抑郁症影响的临床研究现状,并根据受试者的特征进一步分类,同时根据Garber的研究对纳入研究中的运动强度进行评级[10],从而更全面的评估HIIT在缓解或治疗抑郁风险或症状方面的有效性,同时对HIIT治疗抑郁症的生物学机制进行了总结与分析。河南大学生命科学学院徐煜翔博士、北京积水潭医院贵州医院李永杰治疗师为该论文的共同第一作者,河南大学生命科学魏建设课题组研究进展。

一、HIIT可降低健康人群患抑郁症的风险
通过对纳入文献的分析发现,针对健康人群所采用的HIIT方式主要集中在两种类型上:短间歇高强度间歇训练(short-interval high-intensity interval training,HIITS)和长间歇高强度间歇训练(long-interval high-intensity interval training,HIITL)。健康人群在经过HIIT治疗后表现出抑郁症量表评分和个体炎症水平显著下降。同时,在一项采用急性HIIT干预的研究中发现参与者在运动后抑郁症量表评分立即降低。这些结果表明,HIIT在降低健康人群抑郁症风险中展现出巨大的潜力。
二、HIIT可减轻其他疾病并发抑郁症患者的抑郁症状
通过进一步对其他疾病并发抑郁症患者采用HIIT干预的研究发现,大多数接受HIIT治疗的参与者抑郁症状得到了缓解,尤其在心血管疾病并发抑郁症患者中治疗效果更加显著。然而,在癌症并发抑郁症患者中抑郁症状并未得到显著的改善。
三、HIIT治疗抑郁症的相关生物学机制
当前在探究运动治疗抑郁症的研究中多采用的运动方式为有氧运动,但由于HIIT与其运动特点并不相同,所以在治疗抑郁症中所涉及的相关机制也存在一定的差异。下面本研究将要对HIIT治疗抑郁症的相关生物学机制进行简要的讨论(图1)。
(一)HIIT调节单胺类物质及神经营养因子浓度影响神经重塑与再生
脑源性神经营养因子(brain-derived neurotrophic facto,BDNF)是最重要的神经营养因子之一,可以调节大脑发育、神经可塑性和轴突的生长,在抑郁症和大脑神经相关疾病的发生中发挥着不可替代的作用。同时,BDNF也是一种对运动调节高度敏感的神经营养因子。研究指出运动的形式和强度均会影响BDNF水平的变化,运动诱导BDNF水平增加可能与乳酸的积累有关,运动中肌肉产生的乳酸通过Sirtuin 1脱乙酰酶的激活可以增加BDNF的释放[11]。此外,在临床和动物研究中发现,HIIT可以增加PGC-1α的表达,从而增加 fibronectin type III domain-containing protein 5(FNDC5)的表达进一步促进BDNF的释放[12]。释放的BDNF随后通过BDNF-TrkB-PI3k-Akt和BDNF-TrkB-MAPK/ERK信号通路可以挽救因抑郁症造成的神经元死亡[13]。同时,增加神经元发生、突触活动从而治疗抑郁症状。
(二)HIIT 调节抑郁症患者的 HPA 轴稳态
抑郁症中HPA轴的过度激活造成的糖皮质激素(皮质酮)的分泌被认为是发病因素之一,过度的皮质酮释放会造成HPA轴负反馈机制异常。然而简单的将运动介导的皮质酮水平增加视为一种不良反应是不准确的。生理状态中皮质酮出来可以调节HPA轴功能外,同时具备增加/维持血糖平衡、调节免疫状态的作用。最近的一项研究发现,短期HIIT治疗后受试者体内皮质酮水平升高,但伴随着治疗时间增加后机体内皮质酮浓度会较治疗期基线水平出现明显下降[14]。相反,运动造成的皮质酮改变可以调节HPA轴的功能从而缓解因抑郁症状造成的HPA轴过度激活。
HIIT调节HPA轴稳态的另一个可能原因是,在经HIIT治疗后的抑郁动物模型和前列腺动脉高血压患者中检测到糖皮质激素受体(glucocorticoid receptor, GR)及其mRNA表达增加[15]。GR的增加可以降低糖皮质激素对海马组织的损伤,降低海马萎缩程度,增强了受试者的认知功能并缓解了机体对抑郁症的易感性。同时其还可以恢复因抑郁症造成的HPA轴受损的负反馈功能,从而治疗抑郁症状。
(三)HIIT调节抑郁症炎症水平
病理研究发现抑郁症患者机体中存在炎症反应失控(慢性炎症)现象,具体表现为外周与大脑内免疫细胞过度激活、促炎细胞因子大量释放,造成大脑内神经元损伤、海马组织萎缩、HPA轴功能紊乱。在本文纳入的文献中,有2 项研究报告了 HIIT 治疗后受试者炎症细胞因子 TNF-α 的下降趋势。TNF-α和IL-1的减少可以调节抑郁症中HPA轴的功能障碍,并减少ACTH,CRH和皮质酮的释放。此外,HIIT可以诱导Treg细胞的数量增加进一步对炎症状态进行调节,从而减少大脑内神经毒性小胶质细胞的数量及功能从而调节脑内炎症状态、减少神经元死亡,进而治疗抑郁症状。
IL-6作为一种经典的促炎细胞因子,其浓度的变化不仅可以反映机体的炎症状态,同时也是抑郁症程度的重要指标之一。虽然,纳入文献中报道经HIIT治疗后发现受试者外周循环中IL-6水平显著上升,然而这并不能说明HIIT治疗促进了抑郁症的发生[16]。运动介导的IL-6主要是由骨骼肌产生的,其与单核细胞和脂肪组织来源的IL-6拥有着相反的生物学功能。运动介导的IL-6升高可以抑制了促炎细胞因子TNF-α的产生,同时提升抗炎细胞因子IL-10、IL-1RA的水平,这可能是HIIT后循环中TNF-α水平下降的原因之一。总的来说运动背景下IL-6增加具有抗炎特性,对于抑郁症的治疗发挥了积极的作用。
(四)HIIT调节抑郁症患者的最大摄氧量
抑郁症患者的最大摄氧量能力较健康人群出现降低的现象。在本研究中有多篇研究报道了经HIIT治疗后受试者的最大摄氧能力得到了显著的增加,并缓解了受试者的抑郁症状。这可能归因于最大摄氧能力的提高改善了机体心肺健康,从而促进了脑血管功能、神经元的生长和连接、肠道菌群代谢。此外,较高的最大摄氧量还与更大的大脑体积和蛋白质完整性相关,从而改善了受试者的整体状态与心理健康。
最近的研究报道了一种可能治疗抑郁症的潜在靶点hypoxia inducible factor-1(HIF-1),其通过介导线粒体代谢以应对组织中氧气水平不足而造成的氧化应激现象[17]。通过间歇性低氧适应训练与高压氧疗法均可以提高HIF-1的表达,缓解受试者的抑郁症状。值得注意的是,经HIIT治疗后同样可以提高机体内HIF-1的表达,这也可能是HIIT缓解抑郁症状的原因之一。
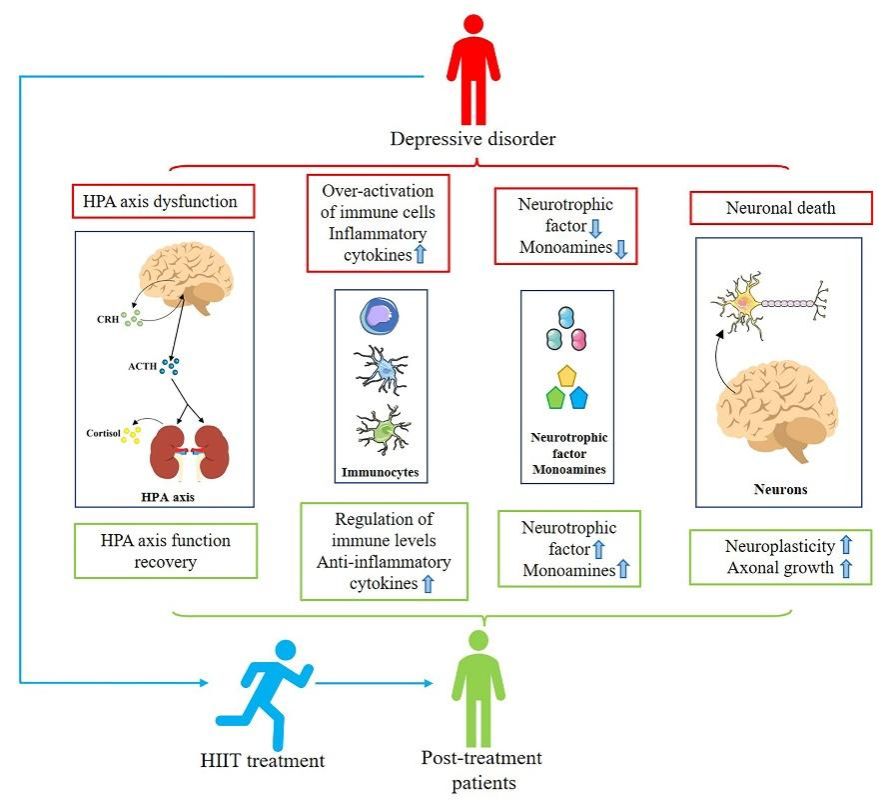
图1 HIIT治疗抑郁症的相关机制
四、总结与展望
通HIIT在降低受试者抑郁症风险与症状中展现出了一定的潜力,其机制可能不仅通过多途径(增加单胺类物质释放、改善机体炎症水平、提升最大摄氧量等)改善了受试者的心理健康程度外,还还提升了机体的健康水平。值得注意的是,在采用HIIT治疗抑郁症的过程中制定一个合适的运动处方是非常必要的,这与治疗效果紧密相关。进行运动处方的制定时需要充分考虑到患者的自身情况(如:年龄、是否具有其他合并症、是否采用其他治疗)、治疗周期、治疗强度等因素。此外,在使用HIIT治疗中是否存在剂量-反应效应等现象仍需要研究人员进一步的探究,进而完善运动介导抑郁症治疗的相关生物学机制。



